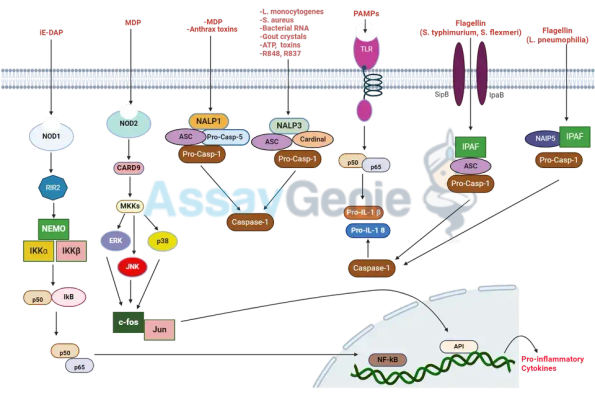
Nod-Like 수용체 신호 전달 경로: 선천적 면역의 핵심
병원체에 대한 일차 방어선인 선천성 면역 체계는 다양한 세포 및 분자 메커니즘으로 구성됩니다. 이 중 NLR(Nod-like Receptor) 신호 전달 경로가 중요한 역할을 합니다. 이들은 병원체 관련 분자 패턴(PAMP) 및 위험 관련 분자 패턴(DAMP)의 세포내 센서 역할을 하는 면역 반응의 중심입니다. 이 기사에서는 NLR 신호 전달 경로의 기본 구성 요소, 주요 단계, 발달 역할 및 질병에 미치는 영향을 자세히 살펴봅니다.
Nod 유사 수용체 신호 전달 경로의 기본 구성요소:
Nod-like 수용체(NLR)는 패턴 인식 수용체(PRR) 계열에 속하며 주로 세포질에 위치합니다. NLR의 기본 구조는 다음과 같습니다.
1. N-말단 효과기 도메인: NLR에 따라 이 도메인은 카스파제 동원 도메인(CARD), 피린 도메인(PYD), 바큘로바이러스 세포사멸 반복 억제제(BIR) 또는 X-연결 세포사멸 단백질 억제제(XIAP)일 수 있습니다. ) 바인딩 도메인.
2. NACHT 도메인: 이 뉴클레오티드 결합 도메인은 올리고머화를 촉진하고 신호 전달에 중추적인 역할을 합니다.
3. C-말단 류신이 풍부한 반복(LRR): 리간드 인식 및 자가 억제에 관여하는 이러한 반복은 부당한 활성화를 방지합니다.
NLRP3 인플라마솜: 중요한 구성 요소
NLR 신호 전달의 주요 단계
NLR 신호 전달 경로의 활성화에는 몇 가지 중요한 단계가 포함됩니다.
1 리간드 인식: NLR은 PAMP(병원체 관련 분자 패턴) 및 DAMP(위험 관련 분자 패턴)를 감지합니다.
2. NLR 활성화: 리간드를 인식하면 NLR은 비활성 상태에서 활성 상태로 전환되는 형태 변화를 겪습니다.
3. 복합체 형성: 활성 NLR은 어댑터 단백질(예: ASC)과 이펙터 단백질(예: 카스파제-1)을 모집하여 경우에 따라 인플라마솜으로 알려진 다중 단백질 복합체를 형성합니다.
NLR 신호 전달 경로
활성화 및 신호
염증복합체 형성과 그 영향
NLR 활성화, 특히 NLRP 서브패밀리의 주요 결과 중 하나는 염증복합체(inflammasome)로 알려진 다중단백질 복합체의 형성입니다. 이 복합체는 IL-1β 및 IL-18과 같은 전염증성 사이토카인의 성숙과 분비에 중요한 역할을 합니다. 염증복합체의 적절한 조절은 면역 반응과 과도한 염증 예방에 필수적입니다.
Nod 유사 수용체의 구조와 기능
발달 및 면역 반응에서의 역할
개발 과정에서 NLR은 다음과 같은 목적으로 필수적입니다.
1. 세포 사멸 및 염증 조절: 조직 리모델링 및 발달에 중요한 세포사멸과 파이롭토시스의 균형을 유지합니다.
2. 면역 체계 개발 형성: NLR은 수지상 세포 및 대식세포와 같은 주요 면역 세포의 성숙과 기능에 영향을 미칩니다.
질병에 미치는 영향
aNLR 신호 전달 경로의 조절 장애는 다양한 질병과 관련이 있습니다.
염증성 장 질환(IBD)
NLR 유전자(예: NOD2)의 돌연변이는 크론병 및 궤양성 대장염과 상당히 연관되어 있습니다.
자가염증 및 자가면역 질환
부적절한 NLR 활성화는 통풍 및 류마티스 관절염과 같은 상태로 이어질 수 있습니다.
암
일부 NLR은 종양 발생에 관여하여 종양 발달을 촉진하거나 억제합니다.
신경퇴행성 질환
신경염증에 NLR이 관여하면 알츠하이머병이나 파킨슨병과 같은 질병과 연결됩니다.
치료적 의미와 과제
NLR 신호전달 경로는 염증성 질환 치료를 위한 잠재적인 치료 표적을 제공합니다. 이 경로의 조절은 크론병, 류마티스 관절염, 제2형 당뇨병과 같은 질환의 치료를 위한 새로운 길을 제공할 수 있습니다. 그러나 NLR과 다른 면역 구성 요소의 복잡한 상호 작용으로 인해 표적 치료법을 개발하는 것이 어렵습니다.
NLR 연구의 미래 방향
지속적인 연구는 NLR 활성화 및 조절의 정확한 메커니즘을 밝히는 것을 목표로 합니다. NLR과 다른 신호 전달 경로 사이의 누화를 이해하면 염증성 질환과 자가면역 질환에 대한 혁신적인 치료법을 위한 길을 열 수 있습니다.
결론:
끄덕임 유사 수용체 신호 전달 경로는 선천성 면역 체계의 중요한 구성 요소입니다. 수용체, 어댑터 및 효과기 분자의 복잡한 네트워크는 감염 및 조직 손상에 대한 신체의 반응을 조정합니다. 연구가 발전함에 따라 이 경로를 활용하는 표적 치료법의 잠재력이 계속 커지고 있으며 다양한 염증성 질환 치료에 대한 희망을 제시하고 있습니다.
참고자료
Philpott, D.J., Sorbara, M.T., Robertson, S.J., Croitoru, K., & Girardin, S.E. (2014). NOD 단백질: 건강과 질병의 염증 조절자. 자연 리뷰 면역학, 14(1), 9-23. https://nature.com/articles/nri3565
Strober, W., & Watanabe, T. (2011). NOD2는 숙주 방어 및 크론병에 관여하는 세포내 선천 면역 센서입니다. 점막 면역학, 4(5), 484-495. https://nature.com/articles/mi201134
슈뢰더, K., & Tschopp, J. (2010). 염증복합체. 세포, 140(6), 821-832. https://cell.com/fulltext/S0092-8674(10)00164-1
Franchi, L., Warner, N., Viani, K., & Núñez, G. (2009). 미생물 인식 및 숙주 방어에서 Nod 유사 수용체의 기능. 면역학적 리뷰, 227(1), 106-128. https://immunologicalreviews.org/browse/volume-227/issue-1
Hise, A.G., Tomalka, J., Ganesan, S., Patel, K., Hall, B.A., & Brown, G.D. (2009). 인간 곰팡이 병원체 Candida albicans에 대한 숙주 방어에서 NLRP3 inflammasome의 필수적인 역할. 세포 숙주 및 미생물, 5(5), 487-497. https://cell.com/cell-host-microbe/fulltext/S1931-3128(09)00155-7
Ting, J.P., Willingham, S.B., & Bergstralh, D.T. (2008). 세포 사멸과 면역의 교차점에 있는 NLR. 자연 리뷰 면역학, 8(5), 372-379. https://nature.com/articles/nri2326
Meylan, E., Tschopp, J., & Karin, M. (2006). 숙주 반응의 세포내 패턴 인식 수용체. 자연, 442(7098), 39-44. https://nature.com/articles/nature04946
데이비스, B.K., Wen, H., & Ting, J.P.(2011). 면역, 염증 및 관련 질병의 염증복합체 NLR. 면역학 연례 검토, 29, 707-735. https://annualreviews.org/doi/10.1146/annurev-immunol-031210-101405
12th Aug 2024
Recent Posts
-
Understanding Myeloid Cell Networks in Cancer Immunotherapy
암 면역 요법에서 골수 세포 네트워크 이해하기면역 요법은 암 치료에 혁신을 가져왔지만, 치료 후 원래의 면역 반응을 재확립하는 데 그 효과는 제한적입니다. 이 기사는 골수 세포 네 …21st Aug 2025 -
PD-L1 in Cancer Immunotherapy: Insights from Recent Research
암 면역 요법에서의 PD-L1: 최근 연구의 통찰 최근 암 면역 요법의 발전은 종양의 면역 회피를 매개하는 프로그램된 세포 사멸 리간드 1 (PD-L1)의 중요한 역할을 강조하고 …21st Aug 2025 -
Role of CD25+FOXP3+CD45RA- Treg Cells in Cancer Prognosis
CD25+FOXP3+CD45RA- Treg 세포의 암 예후에서의 역할서론조절 T 세포(Treg 세포)는 면역 항상성과 내성을 유지하는 데 중요한 역할을 하는 T 세포의 특수한 하위 …1st Aug 2025