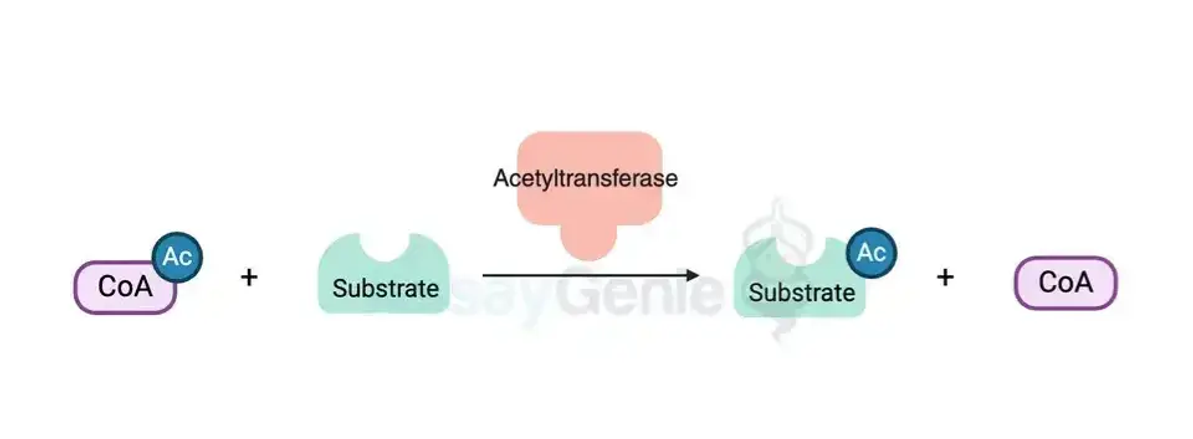
아세틸화의 다각적인 역할 조명: 화학과 생물학의 연결 소개:
분자에 아세틸 작용기를 추가하는 것을 특징으로 하는 화학 공정인 아세틸화는 생화학적 및 생물학적 환경 모두에서 초석이 됩니다. 그 중요성은 기본적인 세포 과정부터 복잡한 질병 발병에 이르기까지 다양한 영역을 포괄합니다. 이 기사는 아세틸화의 복잡한 메커니즘, 다양한 기능, 건강과 질병에 대한 광범위한 영향을 탐구하면서 다면적인 아세틸화 세계를 더 깊이 탐구하려고 노력합니다.
아세틸화 화학:
아세틸화의 생물학적 기능:
1. 유전자 조절: 후생적 조절의 특징인 히스톤 단백질의 아세틸화는 염색질 구조와 유전자 발현을 조절합니다. 히스톤 아세틸트랜스퍼라제(HAT)는 히스톤 꼬리에 아세틸 그룹을 추가하여 양전하를 중화시키고 전사에 도움이 되는 개방형 염색질 형태를 촉진합니다. 반대로, 히스톤 데아세틸라제(HDAC)는 아세틸 그룹을 제거하여 염색질 응축 및 전사 억제를 유발합니다. 히스톤 아세틸화와 탈아세틸화 사이의 이러한 역동적인 상호 작용은 발달, 분화 및 환경 자극에 대한 반응을 포함한 중요한 세포 과정을 지배합니다.
2. 단백질 기능 및 세포 신호 전달: 아세틸화는 또한 세포 신호 전달 경로에 관여하는 수많은 단백질의 기능, 안정성 및 위치를 조절합니다. 단백질 내의 라이신 잔기의 아세틸화는 효소 활성, 단백질-단백질 상호작용 및 세포하 위치를 조절할 수 있습니다. 더욱이, 아세틸화는 전사 인자, 신호 분자 및 대사 효소의 활성을 조절함으로써 세포 신호 전달 계통에서 중추적인 역할을 합니다. 단백질 아세틸화의 조절 장애는 세포 항상성에 깊은 영향을 미치며 암, 신경퇴행성 질환, 대사 증후군을 포함한 다양한 질병의 발병에 기여할 수 있습니다.
건강과 질병에서의 역할:
아세틸화 과정의 조절 장애는 광범위한 인간 질병과 관련되어 있으며 건강과 질병에 대한 중요성이 강조됩니다. 비정상적인 히스톤 아세틸화 패턴은 암세포에서 흔히 관찰되며, 종양 진행 및 전이와 관련된 유전자 발현 프로파일의 변화에 기여합니다. 또한, 단백질 아세틸화의 중단은 알츠하이머병 및 파킨슨병과 같은 신경퇴행성 질환뿐만 아니라 당뇨병 및 비만과 같은 대사 장애와도 관련이 있습니다. 조절되지 않은 아세틸화 경로의 기본 분자 메커니즘을 이해하면 질병 치료 및 예방을 위해 이러한 경로를 표적으로 하는 새로운 치료 중재 개발이 가능해집니다.
치료적 의미:
아세틸화 경로의 치료적 표적화는 다양한 질병을 치료하기 위한 유망한 전략으로 대두되었습니다. 히스톤 데아세틸라제의 소분자 억제제(HDAC 억제제)는 전임상 및 임상 연구에서 효능을 보여 항종양 효과를 입증하고 기존 치료법에 대한 암세포의 민감도를 향상시켰습니다. 또한, 단백질 아세틸화 조절제는 신경퇴행성 장애, 대사성 질환 및 염증성 질환 치료에 대한 잠재력이 연구되고 있습니다. 아세틸화와 탈아세틸화의 균형을 회복함으로써 이러한 치료적 개입은 질병 진행을 완화하고 환자 결과를 개선할 수 있는 잠재력을 보유합니다.
결론:
아세틸화는 세포 과정의 복잡한 네트워크에서 핵심 역할을 하며 유전자 조절, 단백질 기능 및 신진대사에 지대한 영향을 미칩니다. 그것의 조절 장애는 다양한 인간 질병의 발병과 복잡하게 연결되어 있어 건강과 질병에 있어서의 중요성을 강조합니다. 아세틸화에 대한 우리의 이해가 계속 깊어짐에 따라 생리학과 질병에서의 역할을 탐구할 수 있는 새로운 길을 열고 아세틸화 항상성 회복을 목표로 하는 혁신적인 치료 개입과 맞춤형 치료 전략의 길을 열었습니다.
참고자료:
1. Allis, CD, & Jenuwein, T. (2016). 후생적 조절의 분자적 특징. 자연 리뷰 유전학, 17(8), 487-500.
2. Strahl, B.D., & Allis, CD(2000). 공유 히스톤 변형의 언어. 자연, 403(6765), 41–45.
3. 코자리데스, T. (2007). 염색질 변형과 그 기능. 세포, 128(4), 693-705.
4. Choudhary, C., Weinert, B. T., Nishida, Y., Verdin, E., & Mann, M. (2014). 라이신 아세틸화의 성장 환경은 신진대사와 세포 신호 전달을 연결합니다. 자연 리뷰 분자 세포 생물학, 15(8), 536-550.
5. Lundby, A., Lage, K., Weinert, B. T., Bekker-Jensen, D. B., Secher, A., Skovgaard, T., ... & Choudhary, C. (2012). 쥐 조직의 라이신 아세틸화 부위에 대한 단백질체학 분석을 통해 기관 특이성과 세포하 패턴이 밝혀졌습니다. 세포 보고서, 2(2), 419-431.
26th Jun 2024
Recent Posts
-
슈반 세포: 신경 기능을 지원하는 특수 세포
슈반 세포는 신경 기능에 중요한 역할을 하는 세포입니다. 그들은 축삭을 수초화하고 뉴런 사이의 전기 신호 전달을 보장하는 역할을 담당합니다. 슈반 세포는 …25th Sep 2024 -
신경면역학: CNS의 면역체계
신경면역학이란 무엇입니까?신경면역학은 중추신경계(CNS)와 면역체계 사이의 복잡하고 양방향 상호작용을 조사하는 데 전념하는 다학제적 과학 분야입니다. 여기 …25th Sep 2024 -
바르덴부르크 증후군 및 클라인-바르덴부르크 증후군
바르덴부르크 증후군: 색소 침착, 청력 등에 영향을 미치는 희귀 유전 질환바르덴부르크 증후군(WS)은 개인의 외모와 감각 능력의 다양한 측면에 영향을 미치 …25th Sep 2024