하이브리도마 기술: 항체 생산의 혁명
1970년대 Georges Köhler와 César Milstein이 개척한 면역학의 혁신적인 방법인 하이브리도마 기술은 항체 생산 환경을 변화시켰습니다. 이 획기적인 기술은 진단부터 치료 및 기초 연구에 이르기까지 다양한 과학 영역에 지대한 영향을 미쳤습니다. 이 에세이에서 우리는 하이브리도마 기술의 복잡성, 다양한 응용 분야, 질병에 대한 이해와 치료를 발전시키는 중추적인 역할을 탐구합니다.
하이브리도마 기술의 탄생:
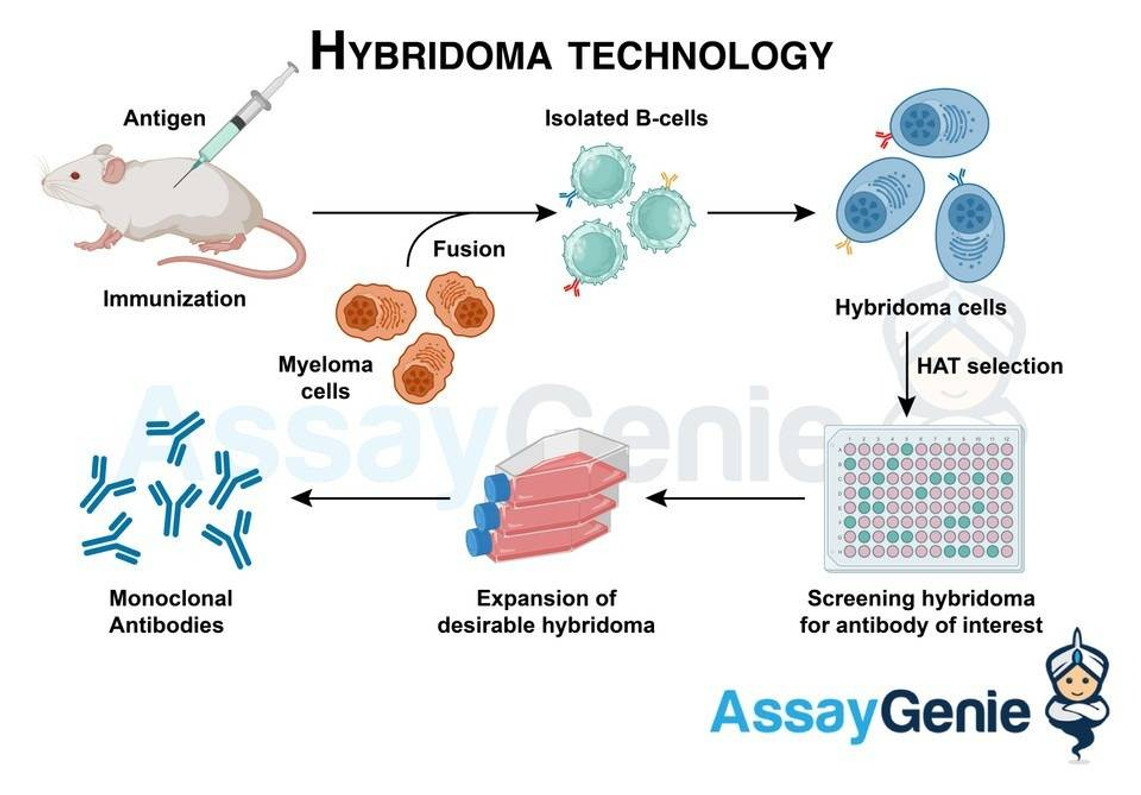
하이브리도마 기술의 기원은 두 가지 서로 다른 세포 유형, 즉 항체 생산을 담당하는 B 세포와 무기한 증식 능력을 보유하는 골수종 세포의 융합에 있습니다. 작은 포유동물(일반적으로 마우스)을 특정 항원으로 면역화함으로써 시작된 이 융합은 하이브리도마라고 불리는 잡종 세포를 생성합니다. 이들 하이브리도마는 B 세포의 항체 생산 능력과 골수종 세포의 불멸성을 물려받아 단클론 항체 생산의 초석을 형성합니다.
항체 생산을 위한 하이브리도마 배양
융합 후, 하이브리도마는 이들 세포만 번성할 수 있는 선택 배지에서 배양됩니다. 이 중요한 단계는 원하는 단일클론 항체를 생산하는 세포의 생존을 보장합니다. 그런 다음 살아남은 하이브리도마를 항체 생산에 대해 스크리닝하고, 원하는 단일클론 항체를 분비하는 하이브리도마를 분리하고 클로닝합니다. 이 클로닝 과정은 동일한 특이성을 지닌 항체의 일관되고 사실상 무한한 공급을 보장합니다.
하이브리도마 기술의 응용:
의료 진단: 질병 탐지를 위한 정밀 도구
치료제: 단클론항체를 이용한 정밀의학
기초 연구: 세포의 신비를 밝히다
하이브리도마 기술은 면역학, 세포 생물학 및 관련 분야의 기초 연구를 추진해 왔습니다. 귀중한 도구인 단일클론항체는 특정 단백질의 연구를 촉진하고, 세포 과정을 밝히고, 다양한 질병의 기초가 되는 분자 메커니즘을 밝혀냅니다.
백신 개발: 예방접종 전략 강화
하이브리도마 기술을 통해 생성된 단일클론항체는 백신 개발에 크게 기여합니다. 이는 항원의 식별 및 특성화를 돕고, 면역 반응을 이해하고 백신 효능을 강화하는 데 중요한 역할을 합니다.
도전과 혁신:
하이브리도마 기술은 상당한 도약을 이루었지만 특히 동물 사용으로 인한 인간의 잠재적인 면역원성에 관한 문제가 대두되었습니다. 이 문제를 해결하기 위해 키메라 항체(인간 불변 영역 포함) 및 인간화 항체(인간의 가변 및 불변 영역 모두 포함)와 같은 혁신이 도입되어 부작용의 위험을 완화했습니다.
또한 파지 디스플레이 및 재조합 DNA 기술과 같은 항체 공학 기술의 발전으로 하이브리도마 기술이 보완되었습니다. 이러한 접근법은 동물의 필요성을 제거할 뿐만 아니라 항체 특성을 정제하기 위한 추가적인 방법을 제공합니다.
결론적으로, 하이브리도마 기술은 복잡한 면역 체계와 배양 세포의 재현성을 결합한 인간의 독창성을 입증하는 것입니다. 진단부터 치료까지, 이 기술을 통해 생산된 단클론 항체의 영향은 헤아릴 수 없습니다. 기술이 계속 발전함에 따라 하이브리도마 기술은 면역 체계의 비밀을 밝히려는 우리의 지속적인 탐구에서 초석으로 남아 있으며, 인류 건강에 도움이 되는 전례 없는 통찰력과 응용 프로그램을 제공합니다.
참고자료
Köhler, G., & Milstein, C. (1975). 미리 정의된 특이성의 항체를 분비하는 융합 세포의 연속 배양. 자연, 256(5517), 495–497.
Mak, T. W., & Saunders, M. E. (2012). 면역 반응: 기본 및 임상 원리. 엘스비어.
Riechmann, L., Clark, M., & Waldmann, H. (1988). 치료를 위해 인간 항체를 재구성합니다. 자연, 332(6162), 323–327.
Chames, P., Van Regenmortel, M., Weiss, E., & Baty, D. (2009). 치료용 항체: 성공, 한계 및 미래에 대한 희망. 영국 약리학 저널, 157(2), 220–233.
Weiner, L.M., Surana, R., & Wang, S. (2010). 단일클론항체: 암 면역치료를 위한 다양한 플랫폼. 자연 리뷰 면역학, 10(5), 317-327.
Kohler, G., & Milstein, C. (1976). 세포 융합에 의한 특정 항체 생산 조직 배양 및 종양주 도출. 유럽 면역학 저널, 6(7), 511–519.
Nelson, A. L., & Dhimolea, E. (2010). 라이처트 JM. 인간 단일클론 항체 치료제 개발 동향. Nature Reviews Drug Discovery, 9(10), 767-774.
Scott, A.M., Wolchok, J.D., & Old, L.J. (2012). 암의 항체 치료. 자연 리뷰 암, 12(4), 278-287.
Winter, G., & Milstein, C. (1991). 인공 항체. 자연, 349(6307), 293–299.
Reff, M. E., Carner, K., Chambers, K. S., Chinn, P. C., Leonard, J. E., Raab, R., ... & Ulland, T. J. (1994). CD20에 대한 키메라 마우스 인간 단일클론 항체에 의한 생체 내 B 세포 고갈. 혈액, 83(2), 435–445.
20th Aug 2024
Recent Posts
-
슈반 세포: 신경 기능을 지원하는 특수 세포
슈반 세포는 신경 기능에 중요한 역할을 하는 세포입니다. 그들은 축삭을 수초화하고 뉴런 사이의 전기 신호 전달을 보장하는 역할을 담당합니다. 슈반 세포는 …25th Sep 2024 -
신경면역학: CNS의 면역체계
신경면역학이란 무엇입니까?신경면역학은 중추신경계(CNS)와 면역체계 사이의 복잡하고 양방향 상호작용을 조사하는 데 전념하는 다학제적 과학 분야입니다. 여기 …25th Sep 2024 -
바르덴부르크 증후군 및 클라인-바르덴부르크 증후군
바르덴부르크 증후군: 색소 침착, 청력 등에 영향을 미치는 희귀 유전 질환바르덴부르크 증후군(WS)은 개인의 외모와 감각 능력의 다양한 측면에 영향을 미치 …25th Sep 2024