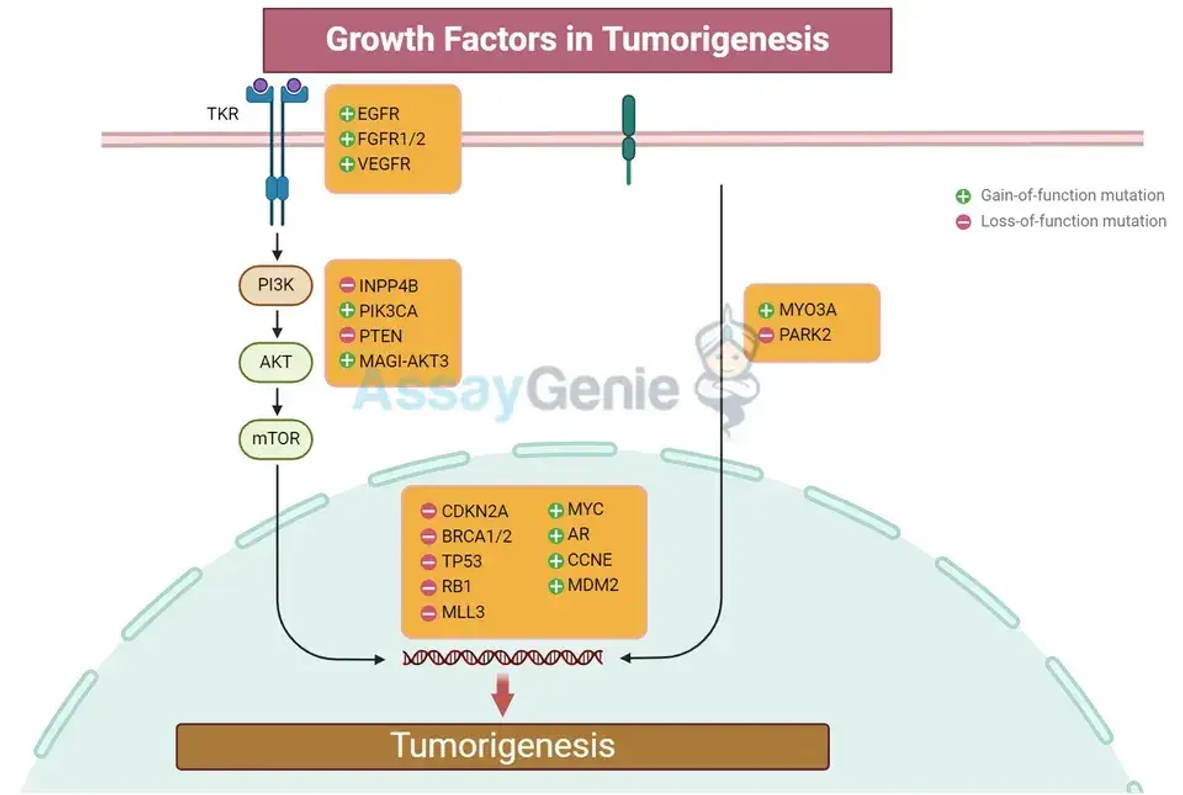
성장 인자는 종양 형성을 촉진하기 위해 협력할 수 있습니다.
소개
세포 조절에서 성장 인자의 역할
성장 인자는 세포 표면의 특정 수용체에 결합하여 세포 성장, 분화, 생존 및 이동을 조절하는 일련의 신호 전달 경로를 촉발하는 단백질입니다. 이는 정상적인 발달과 조직 유지에 필수적입니다. 그러나 이들의 조절이 중단되면 통제할 수 없는 세포 증식과 암이 발생할 수 있습니다.
종양 형성의 주요 성장 인자
종양 형성의 주요 성장 인자
1. 표피 성장 인자(EGF): 세포 성장과 분화를 촉진합니다. 수용체인 EGFR의 과발현 또는 과잉활성은 다양한 암에서 관찰됩니다.
2. 섬유아세포 성장 인자(FGF): 새로운 혈관이 형성되어 종양에 영양분과 산소를 제공하는 과정인 혈관신생에 관여합니다.
3. 혈관 내피 성장 인자(VEGF): 특정 크기를 초과하는 종양 성장에 중요한 혈관 신생을 구체적으로 조절합니다.
4. 변환 성장 인자-베타(TGF-β): 초기 단계에서는 종양 억제 인자로 작용하고 면역 억제 및 종양 미세 환경 자극을 통해 후기 단계에서는 종양 진행을 촉진하는 이중 역할을 합니다.
성장인자 간의 협력 메커니즘
성장인자 간의 협력 메커니즘
성장 인자는 단독으로 작용하지 않고 복잡한 네트워크 내에서 상호 작용하여 종양 형성에 시너지 효과를 가져올 수 있습니다. 다양한 성장 인자 간의 협력은 여러 메커니즘을 통해 발생할 수 있습니다.

신호 경로 간 누화성장 인자는
신호 경로 간 누화성장 인자는
종양의 조절
종양의 조절
성장 인자는 종양 형성을 선호하도록 종양 미세환경을 재구성할 수 있습니다. 예를 들어, VEGF와 FGF는 협력하여 혈관신생을 촉진하여 성장하는 종양에 필요한 영양분과 산소를 공급합니다. TGF-β는 면역 감시를 억제하여 암세포가 면역 탐지를 회피할 수 있도록 합니다.
상피-중간엽 전이(EMT) 유도
상피-중간엽 전이(EMT) 유도
EMT는 상피 세포가 중간엽 특성을 획득하여 이동성과 침습성을 향상시키는 과정입니다. TGF-β 및 EGF와 같은 성장 인자는 EMT를 유도하여 종양 전이를 촉진할 수 있습니다.

성장 인자 신호 전달 및 종양 발생에 대한 새로운 연구 분야
성장 인자 신호 전달 및 종양 발생에 대한 새로운 연구 분야
최근 암 연구의 발전으로 성장 인자와 종양 형성에서의 역할에 대한 연구에서 새로운 차원이 밝혀졌습니다. 그러한 분야 중 하나는 성장 인자 신호 전달을 조절하는 마이크로RNA(miRNA)의 탐구입니다. miRNA는 전사 후 유전자 발현을 조절할 수 있는 작은 비코딩 RNA입니다. 이는 성장 인자 신호 전달 경로에 관여하는 종양 유전자 또는 종양 억제 유전자를 표적으로 삼아 암에서 중요한 역할을 하는 것으로 밝혀졌습니다. miRNA와 성장 인자 사이의 상호 작용을 이해하면 이러한 조절 RNA를 표적으로 삼아 암 치료에 새로운 접근 방식을 모색할 수 있습니다.
또 다른 유망 분야는 암 줄기 세포(CSC)와 성장 인자와의 상호 작용에 대한 연구입니다. CSC는 자가 재생 및 종양 형성을 유도하는 능력을 지닌 암세포의 작은 부분집합입니다. EGF 및 FGF와 같은 성장 인자는 CSC 특성을 유지하고 치료에 대한 저항성을 촉진하는 데 중요한 역할을 하는 것으로 알려져 있습니다. CSC의 성장 인자 신호 전달 경로를 표적으로 삼는 것은 종양을 근절하고 재발을 예방하기 위한 새로운 전략을 제공할 수 있습니다.
잠재적인 치료 표적
잠재적인 치료 표적
암 진행에 성장 인자가 복잡하게 관련되어 있어 여러 가지 잠재적인 치료 목표가 강조되었습니다.
성장 인자 수용체: 표면 국소화와 신호 전달에서 중요한 역할을 고려할 때 성장 인자 수용체는 치료의 주요 표적입니다. 티로신 키나제 억제제(TKI)와 이러한 수용체를 차단하도록 설계된 단일클론 항체는 다양한 암에서 효과를 보여왔습니다.
신호 중간체: PI3K/AKT/mTOR 경로와 같은 성장 인자 수용체 하류의 신호 경로 구성 요소는 개입을 위한 추가 목표를 제공합니다. 이러한 경로를 표적으로 하는 억제제는 암세포의 증식 및 생존 신호를 방해할 수 있습니다.
성장 인자 신호 전달의 음성 조절제: 티로신 키나제를 탈인산화하는 포스파타제와 같은 음성 조절제의 발현 또는 활성을 강화하는 것은 또 다른 치료 방법을 제시합니다. 이러한 조절인자의 기능을 회복하면 암세포의 비정상적인 성장 인자 신호 전달을 약화시킬 수 있습니다.
표 1: 종양 형성에서 성장 인자의 협력
표 1: 종양 형성에서 성장 인자의 협력
성장 인자 | 종양 형성에서의 역할 | 협력 메커니즘 |
세포 증식 및 분화 | 다른 경로와의 누화를 통해 발암성 신호를 증폭합니다. | |
FGF | 혈관신생과 세포 생존 | VEGF와 협력하여 혈관 신생을 향상시킵니다. |
VEGF | 혈관신생 | FGF와 함께 작용하여 종양에 영양분과 산소를 공급합니다. |
TGF-β | 종양 진행 및 면역 억제 | EMT를 유도하고 면역반응을 억제하여 전이를 촉진합니다. |
암 치료에 대한 시사점
이 표는 현재 사용이 승인된 가장 중요한 면역 관문 억제제 중 일부에 대한 빠른 참조 역할을 하며, 표적의 다양성과 치료에 사용되는 광범위한 암을 강조합니다.
결론
암의 성장 인자와 신호 전달 경로에 대한 탐구는 연구 및 치료법 개발을 위한 풍부한 환경을 제공합니다. 성장 인자가 종양 형성 및 치료 저항성을 촉진하는 복잡한 메커니즘을 밝혀냄에 따라 표적 개입에 대한 새로운 기회가 나타납니다. miRNA에 의한 조절부터 암 줄기 세포 집단 유지 및 치료 저항성 유도에 이르기까지 성장 인자의 다각적인 역할에 초점을 맞춤으로써 연구자들은 암을 보다 효과적으로 퇴치하기 위한 혁신적인 전략을 고안할 수 있습니다. 암의 성장 인자 신호 전달을 이해하는 것에서부터 효과적인 표적화까지의 여정에는 어려움이 따르지만, 암 환자를 위한 보다 정확하고 지속적인 치료법을 제공할 수 있다는 가능성이 있습니다.
참고자료
1. Hanahan, D. 및 Weinberg, R.A., 2011. 암의 특징: 차세대. 세포, 144(5), pp.646-674.
2. Lemmon, M.A. 및 Schlessinger, J., 2010. 수용체 티로신 키나제에 의한 세포 신호 전달. 세포, 141(7), pp.1117-1134.
3. Carmeliet, P. 및 Jain, R.K., 2011. 혈관신생의 분자 메커니즘 및 임상 적용. 자연, 473(7347), pp.298-307.
4. Massagué, J., 2008. 암에서의 TGFβ. 세포, 134(2), pp.215-230.
와이즈, S.M. 및 Cheresh, D.A., 2011. 종양 혈관신생: 분자 경로 및 치료 표적. 자연의학, 17(11), pp.1359-1370.
5. Thiery, J.P., Acloque, H., Huang, R.Y.J. 및 Nieto, M.A., 2009. 발달 및 질병의 상피-중간엽 전환. 세포, 139(5), pp.871-890.
6. Prenzel, N., Fischer, O.M., Streit, S., Hart, S. 및 Ullrich, A., 2001. 세포 신호 전달 및 다양화를 위한 중심 요소인 표피 성장 인자 수용체 계열. 내분비 관련 암, 8(1), pp.11-31.
7. Ferrara, N., Hillan, K.J., Gerber, H.P. 및 Novotny, W., 2004. 암 치료를 위한 항-VEGF 항체인 베바시주맙의 발견 및 개발. Nature Reviews Drug Discovery, 3(5), pp.391-400.
8. O'Brien, J., Hayder, H., Zayed, Y. 및 Peng, C., 2018. MicroRNA 생물 발생, 작용 메커니즘 및 순환 개요. 내분비학의 개척지, 9, p.402.
9. Batlle, E. 및 Clevers, H., 2017. 암 줄기 세포 재검토. 뉴잉글랜드 의학저널, 377(13), pp.1250-1261.
10. Suda, K., Tomizawa, K. 및 Fujii, M., 2017. erlotinib에 대한 내성을 획득한 표피 성장 인자 수용체 돌연변이 폐암 세포주에서 상피에서 중간엽으로의 전이. 흉부 종양학 저널, 6(7), pp.1152-1161.
11. Engelman, J.A., Zejnullahu, K., Mitsudomi, T., Song, Y., Hyland, C., Park, J.O., Lindeman, N., Gale, C.M., Zhao, X., Christensen, J., Kosaka, T ., Holmes, A.J., Rogers, A.M., Cappuzzo, F., Mok, T., Lee, C., Johnson, B.E., Cantley, L.C. and Janne, P.A., 2007. MET 증폭은 ERBB3 신호전달을 활성화하여 폐암에서 게피티닙 내성을 유발합니다. 과학, 316(5827), pp.1039-1043.
12. Polivka, J. Jr. 및 Janku, F., 2014. PI3K/AKT/mTOR 경로에서 암 치료를 위한 분자 표적. 약리학 및 치료학, 142(2), pp.164-175.
13. Sun, Y., 2010. 종양 미세환경 및 암 치료 저항성. 암 편지, 289(2), pp.205-210.
2. Lemmon, M.A. 및 Schlessinger, J., 2010. 수용체 티로신 키나제에 의한 세포 신호 전달. 세포, 141(7), pp.1117-1134.
3. Carmeliet, P. 및 Jain, R.K., 2011. 혈관신생의 분자 메커니즘 및 임상 적용. 자연, 473(7347), pp.298-307.
4. Massagué, J., 2008. 암에서의 TGFβ. 세포, 134(2), pp.215-230.
와이즈, S.M. 및 Cheresh, D.A., 2011. 종양 혈관신생: 분자 경로 및 치료 표적. 자연의학, 17(11), pp.1359-1370.
5. Thiery, J.P., Acloque, H., Huang, R.Y.J. 및 Nieto, M.A., 2009. 발달 및 질병의 상피-중간엽 전환. 세포, 139(5), pp.871-890.
6. Prenzel, N., Fischer, O.M., Streit, S., Hart, S. 및 Ullrich, A., 2001. 세포 신호 전달 및 다양화를 위한 중심 요소인 표피 성장 인자 수용체 계열. 내분비 관련 암, 8(1), pp.11-31.
7. Ferrara, N., Hillan, K.J., Gerber, H.P. 및 Novotny, W., 2004. 암 치료를 위한 항-VEGF 항체인 베바시주맙의 발견 및 개발. Nature Reviews Drug Discovery, 3(5), pp.391-400.
8. O'Brien, J., Hayder, H., Zayed, Y. 및 Peng, C., 2018. MicroRNA 생물 발생, 작용 메커니즘 및 순환 개요. 내분비학의 개척지, 9, p.402.
9. Batlle, E. 및 Clevers, H., 2017. 암 줄기 세포 재검토. 뉴잉글랜드 의학저널, 377(13), pp.1250-1261.
10. Suda, K., Tomizawa, K. 및 Fujii, M., 2017. erlotinib에 대한 내성을 획득한 표피 성장 인자 수용체 돌연변이 폐암 세포주에서 상피에서 중간엽으로의 전이. 흉부 종양학 저널, 6(7), pp.1152-1161.
11. Engelman, J.A., Zejnullahu, K., Mitsudomi, T., Song, Y., Hyland, C., Park, J.O., Lindeman, N., Gale, C.M., Zhao, X., Christensen, J., Kosaka, T ., Holmes, A.J., Rogers, A.M., Cappuzzo, F., Mok, T., Lee, C., Johnson, B.E., Cantley, L.C. and Janne, P.A., 2007. MET 증폭은 ERBB3 신호전달을 활성화하여 폐암에서 게피티닙 내성을 유발합니다. 과학, 316(5827), pp.1039-1043.
12. Polivka, J. Jr. 및 Janku, F., 2014. PI3K/AKT/mTOR 경로에서 암 치료를 위한 분자 표적. 약리학 및 치료학, 142(2), pp.164-175.
13. Sun, Y., 2010. 종양 미세환경 및 암 치료 저항성. 암 편지, 289(2), pp.205-210.
25th Jun 2024
Recent Posts
-
슈반 세포: 신경 기능을 지원하는 특수 세포
슈반 세포는 신경 기능에 중요한 역할을 하는 세포입니다. 그들은 축삭을 수초화하고 뉴런 사이의 전기 신호 전달을 보장하는 역할을 담당합니다. 슈반 세포는 …25th Sep 2024 -
신경면역학: CNS의 면역체계
신경면역학이란 무엇입니까?신경면역학은 중추신경계(CNS)와 면역체계 사이의 복잡하고 양방향 상호작용을 조사하는 데 전념하는 다학제적 과학 분야입니다. 여기 …25th Sep 2024 -
바르덴부르크 증후군 및 클라인-바르덴부르크 증후군
바르덴부르크 증후군: 색소 침착, 청력 등에 영향을 미치는 희귀 유전 질환바르덴부르크 증후군(WS)은 개인의 외모와 감각 능력의 다양한 측면에 영향을 미치 …25th Sep 2024