TGF-베타 신호 전달 경로의 복잡성 해독
TGF-β(Transforming Growth Factor-Beta) 신호 전달 경로는 배아 발달부터 조직 항상성 및 면역 반응 조절에 이르기까지 다양한 세포 과정을 조정하는 데 중추적인 역할을 합니다. 이 복잡한 경로는 세포 균형을 유지하는 데 중요하며, 조절 장애는 암, 섬유증, 면역 장애를 비롯한 수많은 질병의 원인이 될 수 있습니다. 이 기사에서는 TGF-β 신호 전달 경로를 특징짓는 주요 구성 요소와 메커니즘을 탐구합니다.
TGF-베타 신호전달 경로의 주요 구성요소:
TGF-베타 신호 전달 캐스케이드:
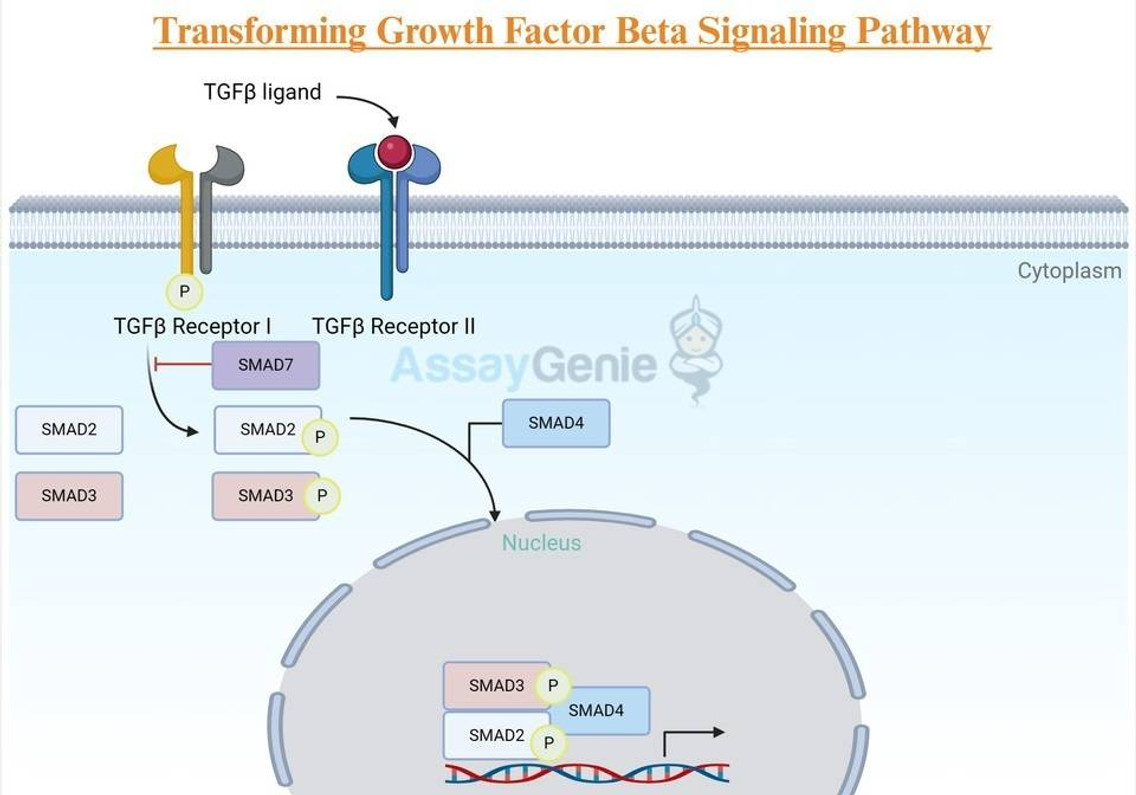
리간드 결합 및 수용체 활성화: TGF-β 리간드는 TGF-βRII의 세포외 도메인에 결합하여 TGF-βRII가 TGF-βRI를 인산화할 수 있도록 하는 형태 변화를 유도합니다. 이 인산화 사건은 TGF-βRI를 활성화하여 하류 신호 전달을 시작합니다.
Smad 활성화: 활성화된 TGF-βRI는 Smad2와 Smad3를 인산화하여 Smad4와의 연관성을 촉진합니다. 이 Smad 복합체는 핵으로 이동하여 DNA 결합 단백질과 상호 작용하여 유전자 전사를 조절합니다.
유전자 전사 조절: 핵 내에서 Smad 복합체는 전사 인자 역할을 하여 표적 유전자의 발현을 조절합니다. TGF-β 신호전달은 상황과 세포 환경에 따라 유전자 전사를 활성화하거나 억제할 수 있습니다.
다른 신호 경로와의 누화: TGF-β 경로는 Wnt, Notch 및 MAPK 경로를 포함한 다양한 다른 신호 전달 계통과 상호 작용하여 복잡한 조절 누화 네트워크를 형성합니다. 이러한 통합을 통해 세포는 다양한 신호에 대한 반응을 정확하게 조정할 수 있습니다.
TGF-베타 신호전달 경로의 생리학적 기능:
배아 발달: TGF-β 신호 전달은 배아 발달에 중요하며 세포 분화, 조직 패턴화 및 기관 형성에 영향을 미칩니다. 발달 중 이 경로의 조절 장애는 선천성 기형을 초래할 수 있습니다.
세포 증식 및 세포사멸: TGF-β는 세포 증식의 강력한 조절인자로 작용하여 세포 상황에 따라 자극 효과와 억제 효과를 모두 발휘합니다. 또한 TGF-β는 세포사멸에 중요한 역할을 하여 손상되거나 불필요한 세포를 제거합니다.
면역 반응: TGF-β는 면역 조절의 핵심 역할을 하며 면역 세포의 발달과 기능에 영향을 미칩니다. 이는 면역 미세환경에 따라 면역억제 인자 및 염증 매개체 역할을 할 수 있습니다.
조직 복구 및 섬유증: TGF-β는 조직 복구 및 상처 치유에 필수적입니다. 그러나 이 경로의 지속적인 활성화는 과도한 콜라겐 침착과 섬유증을 유발하여 다양한 기관의 병리학적 상태를 유발할 수 있습니다.
치료적 혁신을 위한 TGF-β 표적화
TGF-β 신호 전달 경로를 표적으로 하는 치료 전략은 다양하며 특정 질병 상황에 맞게 조정됩니다. 과잉 활성화의 경우 주요 활성화 구성 요소를 방해하는 억제제가 암 및 섬유증 장애의 비정상적인 신호 전달에 대응하기 위해 개발 중입니다. Smad 매개 신호 조절의 정확성에는 유전자 발현과 세포 항상성에 정확하게 영향을 미치는 소분자와 펩타이드가 포함됩니다. MAPK 및 PI3K/Akt와 같은 비Smad 경로는 전체 TGF-β 반응을 미세 조정하기 위한 추가 목표를 제시합니다.
반대로, 조직 손상과 같이 TGF-β 활성이 억제된 상태에서는 성장 인자 및 유전자 치료법을 사용하여 재생 목적을 위한 신호 전달을 강화하는 치료법이 즉각적으로 적용됩니다. 진화하는 패러다임은 잠재적인 부작용을 최소화하면서 시너지 효과를 내기 위해 TGF-β 경로의 다양한 측면을 표적으로 하는 치료법의 결합을 강조합니다. 이 연구는 다양한 병리학적 상태에 대한 맞춤형 개입을 제공하는 정밀 의학 전략을 통해 암, 섬유증 및 재생의학 응용을 포함한 다양한 질병에 대한 치료법에 혁명을 일으킬 가능성을 제시합니다.
참고자료
Massague, J. (2012). 맥락에서 TGFβ 신호 전달. 자연 리뷰 분자 세포 생물학, 13(10), 616-630.
Derynck, R., & Budi, E.H.(2019). TGF-β 계열 신호 전달의 특이성, 다양성 및 제어. 과학 신호 전달, 12(570), eaav5183.
데이비드, C.J., & Massagué, J. (2018). 발달, 면역 및 암에서 TGFβ 작용의 상황 결정 요인. 자연 리뷰 분자 세포 생물학, 19(7), 419-435.
Heldin, C. H., & Moustakas, A. (2016). TGF-β 계열 구성원에 대한 신호 수용체. 생물학의 Cold Spring Harbor 관점, 8(8), a022053.
이쿠시마, H., & Miyazono, K. (2010). TGFβ 신호 전달: 암 진행의 복잡한 웹. 자연 리뷰 암, 10(6), 415-424.
Derynck, R., & Zhang, Y. E. (2003). TGF-β 계열 신호 전달의 Smad 종속 및 Smad 독립적 경로. 자연, 425(6958), 577-584.
Shi, Y., & Massagué, J. (2003). 세포막에서 핵으로의 TGF-β 신호 전달 메커니즘. 세포, 113(6), 685-700.
Miyazawa, K., & Miyazono, K. (2017). 억제성 Smads에 의한 TGF-β 계열 신호전달의 조절. 생물학의 콜드 스프링 하버 관점(Cold Spring Harbor Perspectives in Biology), 9(3), a022095.
30th Aug 2024
Recent Posts
-
슈반 세포: 신경 기능을 지원하는 특수 세포
슈반 세포는 신경 기능에 중요한 역할을 하는 세포입니다. 그들은 축삭을 수초화하고 뉴런 사이의 전기 신호 전달을 보장하는 역할을 담당합니다. 슈반 세포는 …25th Sep 2024 -
신경면역학: CNS의 면역체계
신경면역학이란 무엇입니까?신경면역학은 중추신경계(CNS)와 면역체계 사이의 복잡하고 양방향 상호작용을 조사하는 데 전념하는 다학제적 과학 분야입니다. 여기 …25th Sep 2024 -
바르덴부르크 증후군 및 클라인-바르덴부르크 증후군
바르덴부르크 증후군: 색소 침착, 청력 등에 영향을 미치는 희귀 유전 질환바르덴부르크 증후군(WS)은 개인의 외모와 감각 능력의 다양한 측면에 영향을 미치 …25th Sep 2024