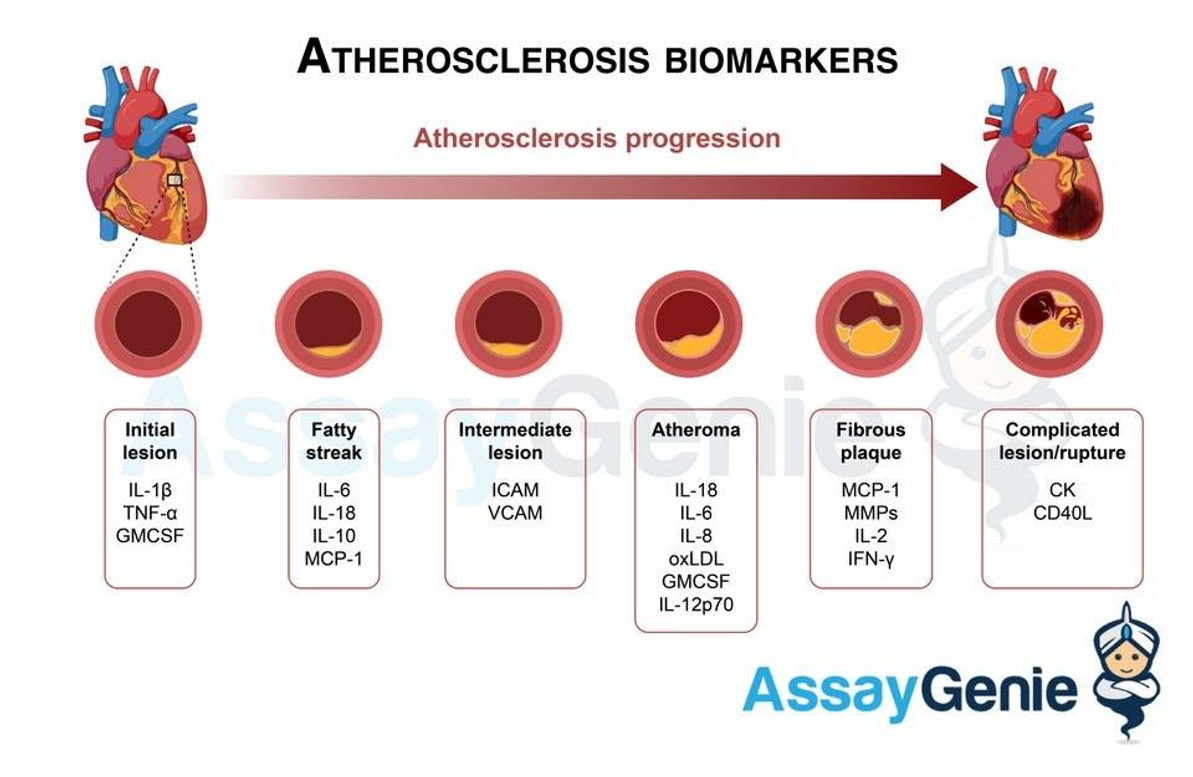
죽상동맥경화증의 바이오마커 및 염증 마커
죽상동맥경화증은 복합 염증성 질환이기 때문에 치주질환, 자가면역질환(예: 당뇨병, RA, SLE)과 같은 죽상동맥경화증 관련 질환의 바이오마커뿐만 아니라 질병의 진행에 기여하는 영향력 있는 바이오마커가 많이 있습니다. 바이오마커는 생물학적, 병리학적 과정 및 약리학적 반응을 평가하기 위해 측정되는 단백질, DNA 및 mRNA일 수 있습니다. 바이오마커는 질병 단계에 따라 초기, 예측 및 예후 바이오마커로 분류될 수 있습니다(Huang et al., 2010).
질병에 대한 바이오마커를 식별하고 치료 목표를 찾는 것은 연구 및 치료와 전반적인 인구 사망률 및 질병률에 매우 중요합니다(Uno 및 Nicholls, 2010). 증상을 나타내기까지 수십 년이 걸릴 수 있는 죽상동맥경화증과 같은 진행성 질병의 바이오마커를 조사하는 좋은 접근 방식은 질병의 여러 단계와 관련된 별도의 마커를 식별하는 것입니다. 그러나 진행 중인 연구에서는 특히 다음과 같은 프로 및 항염증 매개체 중 일부에 중점을 두었습니다. 앞서 논의한 바와 같이 죽상경화증 관련 세포: EC, SMC 및 대식세포는 모두 중요한 바이오마커의 생산자입니다.
항염증성 사이토카인: 인터루킨 10(IL-10)
IL-10은 IFN-감마, TNF-알파, GM-CSF의 발현 및 T 세포의 증식을 억제하는 다발성 항염증성 림포카인으로 분류됩니다. 면역 체계가 완전히 기능하려면 전신 순환에 염증 유발 분자와 항염증 분자의 균형이 있어야 합니다. IL-10 결핍은 RA, SLE(Pyo et al., 2003) 및 UAS를 포함한 염증과 관련된 수많은 질병에서 보고되었으며, 환자는 혈청 내 TNF-α와 IL-10 수준의 불균형을 나타냅니다(Waehre et al., 2002 ). 죽상동맥경화증에서 IL-10 결핍은 Th1 사이토카인 생산을 억제하고(Fiorentino et al., 1991), 지방 줄무늬 형성과 단백질 분해 및 응고 활성을 증가시키고(Caligiuri et al., 2003), CC 케모카인 생성을 감소시켜 다음을 초래합니다. 백혈구 원점 복귀 및 하향은 ICAM-1을 조절합니다. 또한 MMP 생성을 감소시켜 플라크 불안정화 예방에도 기여합니다. 그러나 죽상경화증과 관련된 다른 사이토카인과 마찬가지로 환자의 혈청 IL-10 수준은 연구와 질병 유형에 따라 다릅니다(Stenvinkel et al., 2005). IL-10은 IL-12와 교차 조절 역할을 하며 IL-12의 oxLDL 유도 방출을 억제합니다(Uyemura et al., 1996).
주로 전염증성 사이토카인: 종양 괴사 인자 알파(TNF-α)
TNF-알파는 다발성 전염증성 사이토카인이며 주로 단핵구와 대식세포에 의해 수출됩니다. TNF 수용체(TNFR)를 통한 TNF 신호(Fragoso et al., 2013), TNFR은 내피 세포에서 발견되며 궁극적으로 세포 생존, 증식, 염증 및 면역 조절을 담당하는 NF-Kappa Beta를 활성화합니다. 많은 염증성 마커 유전자는 NF-kappa 베타 프로모터 영역으로 구성되어 있으므로 단백질 발현이 TNF-α에 의해 조절된다면 이는 전염증성 마커로 간주될 수 있습니다. 이는 죽종 형성의 모든 단계, 즉 개시, 발생, 감수성, 중증도 및 치료에 대한 반응에 관여합니다(Fragoso et al., 2013). TNF-α는 케모카인(IL-6, CRP) 및 사이토카인의 생성, 접착 분자(ICAM-1, VCAM-1)의 발현, 백혈구 동원, 평활근 세포 증식 및 지질 대사 유도(HDL 감소)에 관여합니다. 활동)(Bruunsgaard et al., 2000). TNF-α 농도는 상응하는 혈청 샘플에서보다 죽상경화성 대동맥의 내막 비후에서 200배 더 높습니다(Rus and Vlaicu, 1991). 1년 동안 항-TNF-α로 치료받은 RA 및 AS 환자를 대상으로 실시한 연구에서는 대동맥 경직이 크게 감소했습니다(Angel et al., 2012).
인터페론 감마(IFN-γ)
IFN-γ는 유일한 유형 II 인터페론이고, 유형 I 인터페론에는 α, β 및 δ가 포함됩니다. IFN-감마를 생성하는 세포에는 활성화된 T 림프구(CD4+ Th1 세포), 자연 살해 세포, 단핵구/대식세포, 수지상 세포 및 B 세포가 포함됩니다. 항원 제시 세포에 의해 방출된 사이토카인 IL-12 및 IL-18은 이들 세포로부터 IFN-γ 분비를 활성화합니다. IFN-감마에는 여러 가지 동맥경화 유발 역할이 있습니다. IFN-감마 신호전달은 T 세포, 대식세포 및 NK 세포와 같은 면역 세포, 클래스 I 및 II 주조직적합성 복합체(MHC) 분자, 사이토카인 생산 및 병변 부위에서 접착 분자 및 케모카인의 발현 증가를 활성화합니다. (Harvey와 Ramji, 2005, Tenger 외, 2005). IFN-감마는 전염증성 사이토카인으로 알려져 있지만 죽상동맥경화증에서 전염증성 및 항염증성 역할을 모두 수행할 가능성이 높습니다(Muhl and Pfeilschifter, 2003). IFN-감마는 전 염증성 사이토카인으로서 죽상동맥경화증의 여러 단계, 즉 거품 세포 형성, 면역 반응 및 플라크 발생에 관여합니다(McLaren et al., 2009). 이 사이토카인에만 초점을 맞춘 치료법은 죽종 발병 예방에 막대한 잠재력을 가지고 있으며, 가용성 IFN-γR을 코딩하는 플라스미드에 의한 IFN-감마 중화를 입증하는 연구는 마우스 모델에서 병변 진행을 감소시켰습니다(Gotsman and Lictman, 2007).
인터루킨 6(IL-6)
IL-6은 단핵구/대식세포, 지방 조직 및 내피 세포에 의해 생산되는 당단백질입니다. IL-6은 SMC 증식, 대식세포로부터의 MCP-1 분비 및 EC에서의 ICAM-1 발현을 자극합니다. 증가된 IL-6 혈장 농도는 불안정 협심증의 이환율 및 사망률과 관련이 있습니다(Koenig and Khuseyinova, 2007). 경동맥 및 관상동맥 환자에서 IL-6은 대조군보다 유의하게 더 높은 발현 수준을 나타냈고 총경동맥의 내강 직경과 상관관계가 있었으며 유용한 바이오마커로 간주되었습니다(Larsson et al., 2005). IL-6 및 IL-8은 정상 동맥벽보다 섬유성 플라크에서 상당히 높은 수준을 나타냈습니다(Rus et al., 1996).
인터루킨 2(IL-2)
과립구 대식세포 콜로니 자극 인자(GMCSF)
GM-CSF는 전구 세포를 성숙한 과립구 및 대식세포로의 분화와 DC의 증식을 담당하는 사이토카인입니다(Alberts-Grill et al., 2013). 이는 염증 개시의 손상 단계에 대한 반응의 핵심 중재자입니다. 단백질 및 mRNA 연구를 통해 질병이 없는 동맥에서 GM-CSF가 존재하고 죽상동맥경화증이 있는 인간 관상 동맥에서 이의 상향 조절이 확인되었습니다(Plenz et al., 1997). 질병이 있는 동맥에서 GM-CSF의 발현은 내피 세포에 의한 사이토카인 방출을 유도하는 oxLDL의 과도한 양으로 인해 발생할 수 있습니다. 과립구와 대식세포를 조절하는 GM-CSF의 능력은 플라크 진행에 기여합니다(Shaposhnik et al., 2007).
인터루킨 1 베타(IL-1β)
IL-1 계열 중에서 IL-1 베타는 인간에서 순환하는 가장 우세한 이소형입니다. 혈관 세포는 IL-1β 신호 전달을 생성하고 표적이 될 수 있습니다. IL-1β는 IL-1RI(수용체)에 결합하여 MAPK 경로를 통해 신호를 보내고 TF 및 NF-κβ를 활성화하여 염증 유발 유전자 발현을 유발합니다(Chamberlain et al., 2006). 죽상경화증에서 IL-1β는 질병의 모든 단계에서 중요한 기여자로 간주됩니다. 이는 접착 분자 발현, 혈관 투과성 및 SMC 증식을 증가시킵니다(Apostolakis et al., 2008).
인터루킨 12p70(IL-12p70)
IL-12는 Th1 및 Th2 세포 반응의 중요한 조절자입니다. 이는 활성화된 단핵구에 의해 생산되며 T 세포 성장 인자입니다. IL-12 발현은 oxLDL에 의한 단핵구 활성화에 의해 시작될 수 있지만 최소 변형(MM)-LDL은 아닙니다. IL-12 p40 mRNA와 IL-12 p70 단백질은 죽종에서 풍부하게 발견되었습니다(Uyemura et al., 1996).
Il-18은 IL-1β와 함께 IL-1 계열의 구성원입니다. 단핵구/대식세포, T 및 B 세포, 수지상 세포 및 상피 세포와 같은 광범위한 세포가 염증 유발성 IFN-γ 유도 사이토카인을 발현합니다(Apostolakis et al., 2008). IL-18 유전자는 염색체 11번: 위치 11q22.2-q22.3에서 발견됩니다(Okamura et al., 1995).
IL-18은 류마티스 관절염, 전신성 홍반성 루푸스 및 피부 질환, 건선 및 아토피성 피부염과 같은 염증성 질환과 관련이 있습니다(Sims and Smith, 2010). 대부분의 사이토카인과 달리 IL-18은 자극제 없이 구성적으로 발현됩니다. 죽상경화증에서 IL-18은 많은 역할을 합니다. 이는 병변 발달 부위에서 만성 염증에 크게 기여하는 사이토카인 GM-CSF, TNF-α, IL-1β, IL-6 및 케모카인 IL-8을 유도합니다. 가장 많이 연구된 IL-18이 면역 세포에 미치는 영향은 Th1 세포에서 강력한 양의 IFN-γ를 자극하는 능력입니다. IL-12와 IL-18의 조합은 또한 더 넓은 범위의 세포, CD8+ T 세포, B 세포 및 NK 세포에서 IFN-γ를 생성합니다(Arend et al., 2008).
IL-18 연구는 죽상동맥경화성 병변에서 대식세포와 함께 국소화되는 IL-18의 존재를 보여 주었지만 건강한 동맥 부위에는 존재하지 않습니다. 마우스 모델에서 IL-18은 IFN-γ 방출을 통해 죽상경화증을 강화합니다(Whitman et al., 2002). 또한, 경동맥 및 대동맥 죽종에서 IL-18의 수치 증가는 플라크 불안정화 가능성의 증가와 상관관계가 있었습니다. 그러나 연구에서는 실험 모델에 따라 IL-18의 역할을 동맥경화 촉진제 또는 항동맥경화증으로 설명하는 상충되는 결과를 보여줍니다(Arend et al., 2008). IL-18은 IFN-γ와 함께 병변에서 CXCL16 발현을 높이는 데 영향을 미치는 것으로 나타났습니다(Tenger et al., 2004). 대동맥 평활근 세포에서 CXCL16 의존성 ASMC 증식은 IL-18에 의해 매개됩니다(Chandrasekar, et al., 2005). 면역 세포 외에도 IL-18은 내피 세포 발현에도 영향을 미치며, IL-18은 접착 분자 ICAM-1 및 VCAM-1을 상향 조절합니다(Apostolakis et al., 2008).
인터루킨 18(IL-18)
Il-18은 IL-1β와 함께 IL-1 계열의 구성원입니다. 단핵구/대식세포, T 및 B 세포, 수지상 세포 및 상피 세포와 같은 광범위한 세포가 염증 유발성 IFN-γ 유도 사이토카인을 발현합니다(Apostolakis et al., 2008). IL-18 유전자는 염색체 11번: 위치 11q22.2-q22.3에서 발견됩니다(Okamura et al., 1995).
IL-18은 류마티스 관절염, 전신성 홍반성 루푸스 및 피부 질환, 건선 및 아토피성 피부염과 같은 염증성 질환과 관련이 있습니다(Sims and Smith, 2010). 대부분의 사이토카인과 달리 IL-18은 자극제 없이 구성적으로 발현됩니다. 죽상경화증에서 IL-18은 많은 역할을 합니다. 이는 병변 발달 부위에서 만성 염증에 크게 기여하는 사이토카인 GM-CSF, TNF-α, IL-1β, IL-6 및 케모카인 IL-8을 유도합니다. 가장 많이 연구된 IL-18이 면역 세포에 미치는 영향은 Th1 세포에서 강력한 양의 IFN-γ를 자극하는 능력입니다. IL-12와 IL-18의 조합은 또한 더 넓은 범위의 세포, CD8+ T 세포, B 세포 및 NK 세포에서 IFN-γ를 생성합니다(Arend et al., 2008).
IL-18 연구는 죽상동맥경화성 병변에서 대식세포와 함께 국소화되는 IL-18의 존재를 보여 주었지만 건강한 동맥 부위에는 존재하지 않습니다. 마우스 모델에서 IL-18은 IFN-γ 방출을 통해 죽상경화증을 강화합니다(Whitman et al., 2002). 또한, 경동맥 및 대동맥 죽종에서 IL-18의 수치 증가는 플라크 불안정화 가능성의 증가와 상관관계가 있었습니다. 그러나 연구에서는 실험 모델에 따라 IL-18의 역할을 동맥경화 촉진제 또는 항동맥경화증으로 설명하는 상충되는 결과를 보여줍니다(Arend et al., 2008). IL-18은 IFN-γ와 함께 병변에서 CXCL16 발현을 높이는 데 영향을 미치는 것으로 나타났습니다(Tenger et al., 2004). 대동맥 평활근 세포에서 CXCL16 의존성 ASMC 증식은 IL-18에 의해 매개됩니다(Chandrasekar, et al., 2005). 면역 세포 외에도 IL-18은 내피 세포 발현에도 영향을 미치며, IL-18은 접착 분자 ICAM-1 및 VCAM-1을 상향 조절합니다(Apostolakis et al., 2008).
20th Aug 2024
Recent Posts
-
슈반 세포: 신경 기능을 지원하는 특수 세포
슈반 세포는 신경 기능에 중요한 역할을 하는 세포입니다. 그들은 축삭을 수초화하고 뉴런 사이의 전기 신호 전달을 보장하는 역할을 담당합니다. 슈반 세포는 …25th Sep 2024 -
신경면역학: CNS의 면역체계
신경면역학이란 무엇입니까?신경면역학은 중추신경계(CNS)와 면역체계 사이의 복잡하고 양방향 상호작용을 조사하는 데 전념하는 다학제적 과학 분야입니다. 여기 …25th Sep 2024 -
바르덴부르크 증후군 및 클라인-바르덴부르크 증후군
바르덴부르크 증후군: 색소 침착, 청력 등에 영향을 미치는 희귀 유전 질환바르덴부르크 증후군(WS)은 개인의 외모와 감각 능력의 다양한 측면에 영향을 미치 …25th Sep 2024